Muallif:
Lewis Jackson
Yaratilish Sanasi:
6 Mayl 2021
Yangilanish Sanasi:
1 Iyul 2024
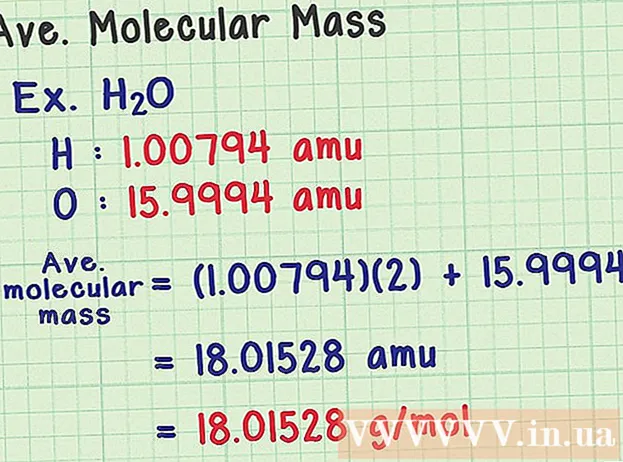
Tarkib
O'rtacha massa atomi atom massasining to'g'ridan-to'g'ri o'lchovi emas. Buning o'rniga, bu elementning odatiy namunasidan atomga o'rtacha massa. Agar siz milliardlab individual atomlarning massasini o'lchashingiz mumkin bo'lsa, buni ularning o'rtacha qiymatini hisoblash orqali bilib olishingiz mumkin. Bizda kimyoviy elementning turli izotoplari haqidagi ma'lumotlarga asoslangan amaliyroq usul mavjud.
Qadamlar
2-qismning 1-qismi: O'rtacha massa atomini hisoblang
Izotoplar va massa atomlarini tushunib oling. Tabiatda aksariyat elementlar turli shakllarda yoki izotoplarda mavjud. Xuddi shu elementning ikkita izotopi orasidagi farq faqat atomdagi neytronlar sonidir, ularning neytronlari massa atomiga ta'sir qiladi. O'rtacha massa atomini hisoblashda bu farqning ta'siri hisobga olinadi va sizga ushbu atomlarning namunasidagi har bir atomning o'rtacha massasi aytiladi.
- Masalan, kumush element (Ag) ikkita tabiiy izotopga ega: Ag-107 va Ag-109 (yoki Ag va Ag). Izotop "massa soni" yoki protondagi va atomdagi neytronlar sonining yig'indisi bilan nomlanadi. Bu shuni anglatadiki, Ag-109 tarkibida Ag-107 ga qaraganda yana ikkita neytron bor, shuning uchun uning atomi biroz og'irroq.

Har bir izotopning massasini toping. Har bir izotop uchun sizga ikkita ma'lumot kerak bo'ladi, uni ma'lumotnomalardan qidirishingiz yoki Internetdan qidirishingiz mumkin, masalan webelements.com. Birinchisi, har bir izotopning massa atomi yoki atom massasi. Ko'proq neytronli izotoplar ko'proq massaga ega.- Masalan, Ag-107 kumush izotopi massa atomiga ega 106,90509 amu (kub atomining birligi). Ag-109 izotopi massasi bilan biroz og'irroq 108,90470.
- Oxirida o'nlik juftlik hujjatlarda bir oz farq qilishi mumkin. Massadan keyin qavs ichida biron bir raqam yozmang.

Har bir izotop uchun tabiiy omon qolish darajasini yozing. Ushbu nisbat izotopning tarqalishini, elementning umumiy atomlariga nisbatan foizda ko'rsatib beradi. Siz ushbu ma'lumotni kubikli atom bilan bitta hujjatda topishingiz mumkin. Barcha izotoplarning tabiiy omon qolishi 100% bo'lishi kerak (garchi yaxlitlash xatosi tufayli biroz farq qilishi mumkin bo'lsa).- Ag-107 izotopi 51,86% ni tashkil qiladi. Ag-109 izotopi 48,14% tezlikda kam uchraydi. Demak, oddiy kumush namunasida 51,86% Ag-107 va 48,14% Ag-109 mavjud.
- Ushbu tirik qolish darajasiga ega bo'lmagan har qanday izotoplar e'tiborga olinmaydi. Ushbu izotoplar tabiiy ravishda er yuzida mavjud emas.

Izotop foizini kasr soniga o'tkazing. Ushbu nisbatni 100 ga bo'lish, o'nli kasr bilan bir xil qiymatga ega bo'ladi.- Yuqoridagi kumush namunada izotoplar nisbati 51,86 / 100 = ga teng 0,5186 va 48,14 / 100 = 0,4814.
O'rtacha kub atomini toping. Elementning o'rtacha massa atomiga ega n izotoplari teng (Atom blokiIzotop 1 * nisbatIzotop 1) + (atom massasiIzotop 2 * nisbatIzotop 2) + ... + (atom massasi)izotoplar n * nisbatizotoplar n. Bu "o'rtacha massa" ning misoli, ya'ni izotopning yashash darajasi qanchalik katta bo'lsa, natijaga uning ta'siri shunchalik katta bo'ladi. Ushbu formulani kumushga qanday qo'llash kerak:
- O'rtacha massa atomiAg = (ommaviy atomAg-107 * nisbatAg-107) + (atom massasiAg-109 * nisbatAg-109)
=(106,90509 * 0,5186) + (108,90470 * 0,4814)
= 55,4410 + 52,4267
= 107,8677 amu. - Natijalarni tekshirish uchun ushbu elementni davriy jadvaldan toping. O'rtacha kubik atom har doim elementning kimyoviy belgisi ostida yoziladi.
- O'rtacha massa atomiAg = (ommaviy atomAg-107 * nisbatAg-107) + (atom massasiAg-109 * nisbatAg-109)
2-qismning 2-qismi: natijalardan foydalanish
Massani atom soniga aylantirish. O'rtacha massa atomlari ushbu elementning odatiy namunasidagi massa va atomlar soni o'rtasidagi bog'liqlikni ko'rsatadi. Bu kimyoviy laboratoriyalarda juda foydali, chunki atomlarni aniq hisoblash deyarli mumkin emas, ammo massalarni aniqlash oson. Masalan, siz kumush namunasini tortishingiz va har 107,8677 amu uchun bitta kumush atomi bo'lishini bilishingiz mumkin.
Molyar massaga aylantirish. Atom massasi birligi juda kichik, shuning uchun kimyogarlar ko'pincha massa uchun gram birligidan foydalanadilar. Yaxshiyamki, bizda ushbu tushunchalarning ta'riflari mavjud, shuning uchun o'zgartirish oson bo'lishi kerak. G / mol natija olish uchun o'rtacha massa atomini 1 g / molga (molyar massa doimiysi) ko'paytiring. Masalan, 107,8677 gramm kumush tarkibida bitta mol kumush atomlari mavjud.
O'rtacha molekulyar massani toping. Molekula atomlar to'plami bo'lganligi sababli, barcha atomlarning massasini qo'shib, molekulyar massani topishingiz mumkin. Agar siz o'rtacha massa atomidan foydalansangiz (ma'lum bir izotop massasi o'rniga), natijada namunadagi tabiatdagi o'rtacha molekulyar massa bo'ladi. Mana bir misol:
- Suv molekulasi H kimyoviy formulasiga ega2O tarkibida ikkita vodorod atomi (H) va bitta kislorod (O) atomi mavjud.
- Vodorodning o'rtacha massa atomi 100794 amuga teng. Kislorodning o'rtacha atom massasi 159994 amu.
- Shunday qilib H ning o'rtacha molekulyar massasi2O (1,00794) (2) + 15,9994 = 18,01528 amu ga teng, bu 18,01528 g / mol ga teng.
Maslahat
- Nisbatan atom massasi tushunchasi ba'zida o'rtacha massa atomi bilan sinonim sifatida ishlatiladi. Bir oz farq bor, chunki atom massasi nisbatan un birlik; bu massani uglerod-12 atomiga nisbatan o'lchovidir. O'rtacha kubik atomini hisoblashda siz atom massasi birligidan foydalansangiz, bu ikki qiymat bir xil.
- Kub atomidan keyingi qavs ichidagi raqam bizga xatoni bildiradi. Masalan, massa atomi 1.0173 (4) elementning normal atomining massa diapazoni taxminan 1.0173 ± 0.0004 ga teng ekanligini anglatadi. Agar u so'ralmasa, sizga ushbu raqamni olishning hojati yo'q.
- Davriy jadvalda quyidagi elementning o'rtacha kubik atomi oldingisidan kattaroq bo'ladi, istisnolardan tashqari. Mana natijalaringizni tekshirishning tezkor usuli.
- 1 atom massasi birligi uglerod-12 atomining 1/12 massasiga teng.
- Izotoplarning omon qolish darajasi er yuzidagi odatdagi tabiiy naqshlar bo'yicha hisoblanadi. Tabiiy bo'lmagan meteoritlar yoki laboratoriyada ishlab chiqarilgan moddalar kabi izotoplar nisbati har xil bo'lishi mumkin, shuning uchun o'rtacha massa atomi ham boshqacha.
Ogohlantirish
- Massa atomlari har doim atom massasi birliklarida (amu yoki u) yoziladi, ba'zan daltonlar (Da) deb nomlanadi. Hech qachon bu sondan keyin boshqa bir massa birligini yozmang (masalan, kilogramm) uni o'zgartirmasdan.
Sizga nima kerak
- Qalam
- Qog'oz
- Noutbuk
- Tabiatda izotoplarning omon qolish darajasi to'g'risidagi ma'lumotlar.
- Izotoplar uchun massaviy atom birligi ma'lumotlari.