Muallif:
Eugene Taylor
Yaratilish Sanasi:
12 Avgust 2021
Yangilanish Sanasi:
22 Iyun 2024
Tarkib
- Qadam bosish
- 2-qismning 1-qismi: Elementning normal elektron konfiguratsiyasi
- 2-qismning 2-qismi: Asil gaz elektron konfiguratsiyasi
- Ogohlantirishlar
Element uchun elektron konfiguratsiyani yozish - bu atomdagi elektronlarning tarqalishiga qarashning yaxshi usuli. Elementga qarab, formula juda uzun bo'lishi mumkin. Shu sababli, olimlar valent elektronlar bo'lmagan elektronlarni ifodalash uchun nobel gazdan foydalanadigan stenografiya yozuvini ishlab chiqdilar. Bu elektron konfiguratsiyani soddalashtiradi va elementning kimyoviy xususiyatlarini tushunishni osonlashtiradi.
Qadam bosish
2-qismning 1-qismi: Elementning normal elektron konfiguratsiyasi
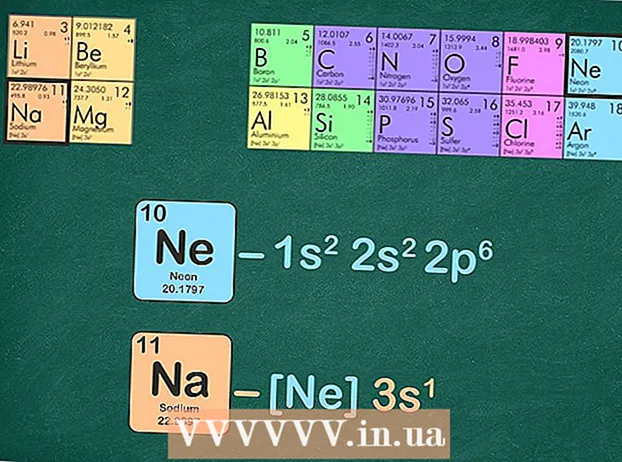
 Elementda mavjud bo'lgan elektronlar sonini aniqlang. Elementning atom raqami uning tarkibidagi protonlar sonini bildiradi. Neytral holatdagi elementlar bir xil miqdordagi proton va elektronga ega bo'lganligi sababli, siz atom raqamidan elementga ega bo'lgan elektronlar sonidan ham foydalanishingiz mumkin. Siz davriy jadvalda topishingiz mumkin bo'lgan atom raqami element uchun to'g'ridan-to'g'ri belgining yuqorisidagi raqamdir.
Elementda mavjud bo'lgan elektronlar sonini aniqlang. Elementning atom raqami uning tarkibidagi protonlar sonini bildiradi. Neytral holatdagi elementlar bir xil miqdordagi proton va elektronga ega bo'lganligi sababli, siz atom raqamidan elementga ega bo'lgan elektronlar sonidan ham foydalanishingiz mumkin. Siz davriy jadvalda topishingiz mumkin bo'lgan atom raqami element uchun to'g'ridan-to'g'ri belgining yuqorisidagi raqamdir. - Masalan, natriy uchun belgi - Na. Na ning atom raqami 11 ga teng.
 Elektron qatlamlari va energiya darajalari haqida bilim. Birinchi elektron qobig'ida faqat s energiya darajasi, ikkinchi elektron qobig'ida ham s, ham p energiya darajasi mavjud. Uchinchi elektron qobig'i s, p va d energiya darajasiga ega. To'rtinchi elektron qobig'i s, p, d va f energiya darajasiga ega. To'rtdan ortiq elektron qobiq mavjud, ammo o'rta maktab kimyo fanida siz odatda faqat birinchi to'rtlikka duch kelasiz.
Elektron qatlamlari va energiya darajalari haqida bilim. Birinchi elektron qobig'ida faqat s energiya darajasi, ikkinchi elektron qobig'ida ham s, ham p energiya darajasi mavjud. Uchinchi elektron qobig'i s, p va d energiya darajasiga ega. To'rtinchi elektron qobig'i s, p, d va f energiya darajasiga ega. To'rtdan ortiq elektron qobiq mavjud, ammo o'rta maktab kimyo fanida siz odatda faqat birinchi to'rtlikka duch kelasiz. - Har bir energiya darajasi 2 tagacha elektronni o'z ichiga olishi mumkin.
- Har bir p energiya darajasi 6 tagacha elektronni o'z ichiga olishi mumkin.
- Har bir d energiya darajasi 10 tagacha elektronni o'z ichiga olishi mumkin.
- Har bir f energiya darajasi 14 tagacha elektronni o'z ichiga olishi mumkin.
 Elektronni to'ldirish qoidalarini bilib oling. Aufbau printsipiga ko'ra, elektronni yuqori energiya darajasiga qo'shishdan oldin siz eng past energiya darajalariga elektronlarni qo'shishingiz kerak. Har bir energiya darajasi bir nechta suborbitalga ega bo'lishi mumkin, ammo har bir suborbital bir vaqtning o'zida ikkita elektronni ushlab turishi mumkin. S energiya darajasi bitta suborbitalga, p 3 suborbitalga, d 5 suborbitalga va f 7 suborbitalga ega.
Elektronni to'ldirish qoidalarini bilib oling. Aufbau printsipiga ko'ra, elektronni yuqori energiya darajasiga qo'shishdan oldin siz eng past energiya darajalariga elektronlarni qo'shishingiz kerak. Har bir energiya darajasi bir nechta suborbitalga ega bo'lishi mumkin, ammo har bir suborbital bir vaqtning o'zida ikkita elektronni ushlab turishi mumkin. S energiya darajasi bitta suborbitalga, p 3 suborbitalga, d 5 suborbitalga va f 7 suborbitalga ega. - D energiya darajasi pastki elektron qobig'ining energiya darajasidan bir oz yuqori energiyaga ega, shuning uchun yuqori energiya darajasi quyi d energiya sathidan ko'ra ko'proq to'ldirilishi mumkin. Elektron konfiguratsiyani yozish uchun bu shunday bo'lishini anglatadi: 1s2s2p3s3p4s3d.
 Elektron konfiguratsiyalarni yozish uchun diagonal konfiguratsiya grafasidan foydalaning. Elektronlarning qanday to'ldirilishini eslashning eng oson usuli bu konfiguratsiya sxemasidan foydalanishdir. Bu erda siz har bir qobiqni va energiya sathlarini yozasiz. Har bir chiziqning yuqori o'ngidan pastki chapiga diagonal chiziqlar torting. Konfiguratsiya sxemasi quyidagicha:
Elektron konfiguratsiyalarni yozish uchun diagonal konfiguratsiya grafasidan foydalaning. Elektronlarning qanday to'ldirilishini eslashning eng oson usuli bu konfiguratsiya sxemasidan foydalanishdir. Bu erda siz har bir qobiqni va energiya sathlarini yozasiz. Har bir chiziqning yuqori o'ngidan pastki chapiga diagonal chiziqlar torting. Konfiguratsiya sxemasi quyidagicha: - 1s
2s 2p
3s 3p 3d
4s 4p 4d 4f
5s 5p 5d 5f
6s 6p 6d
7s 7p - Masalan: Natriyning elektron konfiguratsiyasi (11 ta elektron) quyidagicha: 1s2s2p3s.
- 1s
 Har bir konfiguratsiyaning so'nggi orbitasini aniqlang. Davriy jadvalga qarab, elektron konfiguratsiyaning oxirgi pastki qobig'i va oxirgi energiya darajasi qanday bo'lishini aniqlashingiz mumkin. Dastlab element qaysi blokda tushishini aniqlang (s, p, d yoki f). Keyin element qaysi qatorda ekanligini hisoblang. Nihoyat, element qaysi ustunda joylashganligini hisoblang.
Har bir konfiguratsiyaning so'nggi orbitasini aniqlang. Davriy jadvalga qarab, elektron konfiguratsiyaning oxirgi pastki qobig'i va oxirgi energiya darajasi qanday bo'lishini aniqlashingiz mumkin. Dastlab element qaysi blokda tushishini aniqlang (s, p, d yoki f). Keyin element qaysi qatorda ekanligini hisoblang. Nihoyat, element qaysi ustunda joylashganligini hisoblang. - Masalan, natriy s blokda, shuning uchun uning elektron konfiguratsiyasining oxirgi orbiti s. Bu uchinchi qatorda va birinchi ustunda, shuning uchun oxirgi orbital 3s. Bu sizning oxirgi javobingizni tekshirishning yaxshi usuli.
- D orbital uchun qoida biroz boshqacha. D-blok elementlarining birinchi qatori to'rtinchi qatordan boshlanadi, ammo satr sonidan 1ni olib tashlashingiz kerak, chunki s sathlari d darajalariga qaraganda kamroq energiyaga ega. Masalan: vanadiy 3d bilan tugaydi.
- O'zingizning ishingizni tekshirishning yana bir usuli - barcha ustki nusxalarni qo'shish. Ular elementdagi elektronlar soniga teng bo'lishi kerak. Agar sizda juda kam yoki juda ko'p elektron bo'lsa, ishingizni qayta ko'rib chiqing va qaytadan urinib ko'ring.
2-qismning 2-qismi: Asil gaz elektron konfiguratsiyasi
 Asil gaz elektron konfiguratsiyasini aniqlang. Asil gaz elektron konfiguratsiyasi - bu elementning to'liq elektron konfiguratsiyasini yozishning stsenariy usuli. Asil gaz stenografiyasi elementning elektron konfiguratsiyasini sarhisob qilishda, shu elementning valentlik elektronlari to'g'risida eng kerakli ma'lumotlarni taqdim etishda ishlatiladi.
Asil gaz elektron konfiguratsiyasini aniqlang. Asil gaz elektron konfiguratsiyasi - bu elementning to'liq elektron konfiguratsiyasini yozishning stsenariy usuli. Asil gaz stenografiyasi elementning elektron konfiguratsiyasini sarhisob qilishda, shu elementning valentlik elektronlari to'g'risida eng kerakli ma'lumotlarni taqdim etishda ishlatiladi. - Asil gaz valent elektron bo'lmagan barcha elektronlarni ifodalash uchun almashtiriladi.
- Asil gazlar geliy, neon, argon, kripton, ksenon va radon bo'lib, davriy jadvalning so'nggi ustunida joylashgan.
 O'zingizning elementingiz uchun eng yaxshi gazni aniqlang. Elementning davri - bu element joylashgan gorizontal qator. Agar element davriy jadvalning to'rtinchi qatorida bo'lsa, u to'rtinchi davrda. Siz foydalanadigan olijanob gaz uchinchi davrga to'g'ri keladi. Quyida zo'r gazlar va ularning davrlari ro'yxati keltirilgan:
O'zingizning elementingiz uchun eng yaxshi gazni aniqlang. Elementning davri - bu element joylashgan gorizontal qator. Agar element davriy jadvalning to'rtinchi qatorida bo'lsa, u to'rtinchi davrda. Siz foydalanadigan olijanob gaz uchinchi davrga to'g'ri keladi. Quyida zo'r gazlar va ularning davrlari ro'yxati keltirilgan: - 1: geliy
- 2: Neon
- 3: Argon
- 4: Kripton
- 5: Ksenon
- 6: Radon
- Masalan, natriy 3-davrda. Biz neondan foydalanamiz, chunki u gazning konfiguratsiyasi uchun 2-davrda.
 Asil gazni xuddi shu miqdordagi gazda bo'lgan elektronlar bilan almashtiring. Buni keyingi bosqichda qilishning bir necha yo'li mavjud. Siz zo'r gazning elektron konfiguratsiyasini yozishingiz mumkin va keyin o'zingizning qiziqishingiz elementida shu konfiguratsiyani almashtirishingiz mumkin. Shu bilan bir qatorda, siz konfiguratsiyani yozayotgan elementdan zo'r gazga ega bo'lgan bir xil miqdordagi elektronni olib tashlashdir.
Asil gazni xuddi shu miqdordagi gazda bo'lgan elektronlar bilan almashtiring. Buni keyingi bosqichda qilishning bir necha yo'li mavjud. Siz zo'r gazning elektron konfiguratsiyasini yozishingiz mumkin va keyin o'zingizning qiziqishingiz elementida shu konfiguratsiyani almashtirishingiz mumkin. Shu bilan bir qatorda, siz konfiguratsiyani yozayotgan elementdan zo'r gazga ega bo'lgan bir xil miqdordagi elektronni olib tashlashdir. - Masalan, natriyning 11 ta, neonning esa 10 ta elektroni bor.
- Natriy uchun to'liq elektron konfiguratsiyasi: 1s22p3s va neon 1s22p. Ko'rib turganingizdek, natriyda 3s bor, ularda neon yo'q, shuning uchun natriy uchun eng yaxshi gaz konfiguratsiyasi [Ne] 3s ga aylanadi.
- Shu bilan bir qatorda, siz o'ntagacha energiya sathining yuqori yozuvlarini hisoblashingiz mumkin. Ushbu energiya sathlarini olib tashlang va qolganlarini qoldiring. Agar siz natriy uchun elektron konfiguratsiyasini yozishda neondan foydalansangiz, sizda bitta elektron qoladi: [Ne] 3s.
Ogohlantirishlar
- Faqat neytral atomda atom soni elektronlar soniga teng. Ion tarkibida boshqacha elektronlar mavjud. Agar ionning zaryadi -1 bo'lsa, unda bitta qo'shimcha elektron bo'ladi. -2 zaryadida ikkita qo'shimcha elektron bor va hokazo.