Muallif:
Helen Garcia
Yaratilish Sanasi:
17 Aprel 2021
Yangilanish Sanasi:
1 Iyul 2024
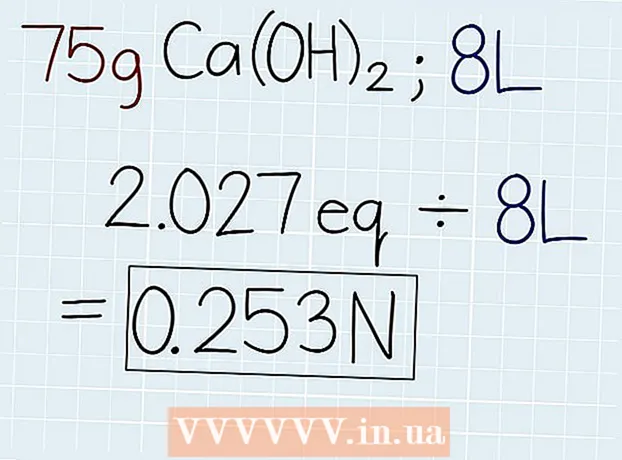
Tarkib
- Qadamlar
- 2 -usul 1: Molarlik orqali normallikni hisoblash
- 2 -usul 2: Ekvivalent massadagi normallikni hisoblash
- Maslahatlar
- Sizga nima kerak
Normallik eritmadagi kislota yoki ishqor kontsentratsiyasini ko'rsatadi. Eritmaning normalligini bilish uchun molyarlikdan ham, molekulaning ekvivalent massasidan ham hisoblashda foydalanish mumkin. Agar siz molyarlikni ishlatishni tanlasangiz, N = M (n) formuladan foydalaning, bu erda M - molarlik, n - vodorod yoki gidroksid molekulalari soni. Agar siz ekvivalent massani ishlatishga qaror qilsangiz, N = ekv ÷ V formuladan foydalaning, bu erda ekvivalentlar soni va V - eritmaning hajmi.
Qadamlar
2 -usul 1: Molarlik orqali normallikni hisoblash
 1 Eritmaning barcha tarkibiy qismlarining molyar massasini qo'shing. Kimyoviy formulaning elementlarini toping, ularning molekulyar massasiga mos keladigan atom massasini aniqlang. Har bir elementning molyar massasini yozing va uni shu elementlar soniga ko'paytiring. Umumiy molyar massani topish uchun barcha komponentlarning molyar massasini qo'shing.
1 Eritmaning barcha tarkibiy qismlarining molyar massasini qo'shing. Kimyoviy formulaning elementlarini toping, ularning molekulyar massasiga mos keladigan atom massasini aniqlang. Har bir elementning molyar massasini yozing va uni shu elementlar soniga ko'paytiring. Umumiy molyar massani topish uchun barcha komponentlarning molyar massasini qo'shing. - Masalan, agar siz sulfat kislotaning molyar massasini bilmoqchi bo'lsangiz (H2SO4), vodorod (1 g), oltingugurt (3 g) va kislorodning (16 g) molyar massasini aniqlang.
- Massani tarkibiy qismlar soniga ko'paytiring. Bizning misolimizda 2 ta vodorod va 4 ta kislorod atomlari mavjud. Vodorodning umumiy molyar massasi 2 x 1 g = 2 g Bu eritmadagi kislorodning molyar massasi 4 x 16 g = 64 g bo'ladi.
- Birgalikda barcha molyar massalarni qo'shing. Siz 2 g + 32 g + 64 g = 98 g / mol olasiz.
- Agar siz qidirayotgan eritmaning molyarligini bilsangiz, to'g'ridan -to'g'ri 4 -bosqichga o'ting.
 2 Eritmaning haqiqiy massasini molyar massaga bo'ling. Eritmaning haqiqiy og'irligini bilib oling. Bu eritma bo'lgan idishda yoki vazifaning o'zida ko'rsatiladi.Keyin eritma massasini ilgari topilgan umumiy molyar massaga bo'ling. Natijada eritmadagi mollar soni bo'ladi, shundan so'ng "mol" yozilishi kerak.
2 Eritmaning haqiqiy massasini molyar massaga bo'ling. Eritmaning haqiqiy og'irligini bilib oling. Bu eritma bo'lgan idishda yoki vazifaning o'zida ko'rsatiladi.Keyin eritma massasini ilgari topilgan umumiy molyar massaga bo'ling. Natijada eritmadagi mollar soni bo'ladi, shundan so'ng "mol" yozilishi kerak. - Masalan, agar siz 100 g H normalligini bilishga harakat qilsangiz2SO412 litr suyuqlikda eriydi, haqiqiy massadan foydalaning va molyarga bo'linadi. Natijada siz quyidagilarni olasiz: 100 g ÷ 98 g / mol = 1,02 mol.
- 1 mol eritmaning 6,02 x 10 atomiga yoki molekulasiga teng.
 3 Molaritivlikni bilish uchun natijani eritma hajmiga litrga bo'ling. Eritmada hisoblangan mol sonini oling va uni o'lchanadigan eritmaning umumiy hajmiga bo'ling. Natijada siz molyarlikni (M) bilib olasiz, uning yordamida siz eritmaning konsentratsiyasini bilib olasiz.
3 Molaritivlikni bilish uchun natijani eritma hajmiga litrga bo'ling. Eritmada hisoblangan mol sonini oling va uni o'lchanadigan eritmaning umumiy hajmiga bo'ling. Natijada siz molyarlikni (M) bilib olasiz, uning yordamida siz eritmaning konsentratsiyasini bilib olasiz. - Bizning misolimiz asosida quyidagi formulani olamiz: 1,02 mol ÷ 12 L = 0,085 M.
Maslahat: agar siz buni hali qilmagan bo'lsangiz, eritmaning hajmini litrga aylantiring. Aks holda, siz noto'g'ri javob olasiz.
 4 Molarlikni vodorod yoki gidroksid molekulalari soniga ko'paytiring. Kislotadagi vodorod atomlarining (H) yoki bazadagi (OH) gidroksid molekulalarining sonini bilish uchun kimyoviy formulaga qarang. Keyin eritmaning molyarligini shu eritmadagi vodorod yoki gidroksid molekulalari soniga ko'paytirib, normal konsentratsiyani yoki normallikni toping. Javobingiz oxirida "N" qisqartmasini yozing.
4 Molarlikni vodorod yoki gidroksid molekulalari soniga ko'paytiring. Kislotadagi vodorod atomlarining (H) yoki bazadagi (OH) gidroksid molekulalarining sonini bilish uchun kimyoviy formulaga qarang. Keyin eritmaning molyarligini shu eritmadagi vodorod yoki gidroksid molekulalari soniga ko'paytirib, normal konsentratsiyani yoki normallikni toping. Javobingiz oxirida "N" qisqartmasini yozing. - Bizning misolimizda sulfat kislota (H2SO4) 2 ta vodorod atomi. Shunday qilib, formula shunday bo'ladi: 0,085 M x 2 = 0,17 N.
- Boshqa misolda, molyarligi 2 M bo'lgan natriy gidroksidi (NaOH) faqat 1 ta gidroksid molekulasiga ega. Shuning uchun formula quyidagicha bo'ladi: 2 M x 1 = 2 N.
2 -usul 2: Ekvivalent massadagi normallikni hisoblash
 1 Eritmaning umumiy molyar massasini aniqlang. Eritmaning kimyoviy formulasini ko'rib chiqing va davriy jadvaldagi har bir elementni toping. Har bir elementning molyar massasini yozing va uni formuladagi elementlar soniga ko'paytiring. Umumiy molyar massani grammda topish uchun barcha molyar massalarni qo'shing.
1 Eritmaning umumiy molyar massasini aniqlang. Eritmaning kimyoviy formulasini ko'rib chiqing va davriy jadvaldagi har bir elementni toping. Har bir elementning molyar massasini yozing va uni formuladagi elementlar soniga ko'paytiring. Umumiy molyar massani grammda topish uchun barcha molyar massalarni qo'shing. - Masalan, agar siz Ca (OH) ning molyar massasini bilmoqchi bo'lsangiz.2, keyin kaltsiy (40 g), kislorod (16 g) va vodorod (1 g) ning molyar massasini aniqlang.
- Formulada kislorod va vodorodning 2 ta atomi bor. Kislorodning umumiy massasi: 2 x 16 g = 32 g, Vodorodning molyar massasi: 2 x 1 g = 2 g bo'ladi.
- 40 g + 32 g + 2 g = 74 g / mol olish uchun barcha molyar massalarni qo'shing.
 2 Molar massani vodorod yoki gidroksid molekulalari soniga bo'ling. Kislota yoki gidroksid (OH) asosidagi vodorod atomlari (H) sonini aniqlang. Olingan umumiy molyar massani 1 mol vodorod yoki gidroksid massasiga teng bo'lgan 1 ekvivalentning og'irligini topish uchun atomlar yoki molekulalar soniga bo'linadi. Javob oxirida ekvivalent massasini anglatuvchi "G.-e." qisqartmasini yozing.
2 Molar massani vodorod yoki gidroksid molekulalari soniga bo'ling. Kislota yoki gidroksid (OH) asosidagi vodorod atomlari (H) sonini aniqlang. Olingan umumiy molyar massani 1 mol vodorod yoki gidroksid massasiga teng bo'lgan 1 ekvivalentning og'irligini topish uchun atomlar yoki molekulalar soniga bo'linadi. Javob oxirida ekvivalent massasini anglatuvchi "G.-e." qisqartmasini yozing. - Bizning misolimizda Ca (OH)2 2 ta vodorod molekulasi, ya'ni ekvivalenti massasi 74 g / mol ga teng bo'ladi ÷ 2 = 37 G.-e.
 3 Eritmaning haqiqiy og'irligini ekvivalent vaznga bo'ling. Ekvivalent massasini bilganingizdan so'ng, uni eritma solingan idishda yoki yechilayotgan masalada ko'rsatilgan eritmaning massasiga bo'ling. Javob echimdagi ekvivalentlar soni bo'ladi, shunda siz normallikni hisoblay olasiz. Javob oxirida "e" qisqartmasini qo'ying.
3 Eritmaning haqiqiy og'irligini ekvivalent vaznga bo'ling. Ekvivalent massasini bilganingizdan so'ng, uni eritma solingan idishda yoki yechilayotgan masalada ko'rsatilgan eritmaning massasiga bo'ling. Javob echimdagi ekvivalentlar soni bo'ladi, shunda siz normallikni hisoblay olasiz. Javob oxirida "e" qisqartmasini qo'ying. - Agar bizning misolimizda 75 g Ca (OH)2, keyin formula quyidagicha bo'ladi: 75 g ÷ 37 G.-e = 2.027 Oe.
 4 Ekvivalentlar sonini eritmaning litr hajmiga bo'ling. Eritmaning umumiy hajmini bilib oling va javobni litr bilan yozing. Hozirgina olingan ekvivalentlar sonini oling va eritmaning hajmiga bo'linib, normalligini bilib oling. Javobingiz oxirida "N" qisqartmasini qo'ying.
4 Ekvivalentlar sonini eritmaning litr hajmiga bo'ling. Eritmaning umumiy hajmini bilib oling va javobni litr bilan yozing. Hozirgina olingan ekvivalentlar sonini oling va eritmaning hajmiga bo'linib, normalligini bilib oling. Javobingiz oxirida "N" qisqartmasini qo'ying. - Agar hajmi 8 litr bo'lgan eritmada 75 g Ca (OH) bo'lsa2, keyin ekvivalentlar sonini hajmga quyidagicha taqsimlang: 2.027 Oe. ÷ 8 l = 0,253 N.
Maslahatlar
- Oddiy kontsentratsiya yoki normallik odatda kislotalar va asoslarni o'lchash uchun ishlatiladi. Agar boshqa eritmaning konsentratsiyasini aniqlash kerak bo'lsa, bu odatda molyarlikni o'lchash yo'li bilan amalga oshiriladi.
Sizga nima kerak
- Davriy jadval
- Kalkulyator